 |
Scorpion Linings del Ecuador |
|
| |
La Oxidación al Detalle |
||
El óxido es un proceso electroquímico.
En una superficie de hierro, ciertas partes actúan como cátodo,
y otras como ánodo. La humedad en la superficie del hierro hace
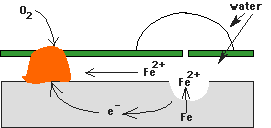
el papel de electrolito entre cátodos y ánodos. En la ilustración hay un pedazo de hierro (gris) cubierto de pintura verde. La pintura tiene un raspón en ella. El agua y el oxígeno del aire obtienen acceso al hierro a través de este raspón. La superficie del hierro bajo la pintura se torna húmeda. Esta humedad provee el camino para que iones migren de un lugar a otro. |
||
 |
Fe = Fe(+2) +
2e- Fe(+2) + 2OH- = Fe(OH)2 4Fe(OH)2 + O2 + H2O = 4Fe(OH)3 |
|
El ánodo puede estar en cualquier parte de la superficie del hierro. Generalmente se ubica en el lugar en donde hay alguna falla microscópica o una impureza en la estructura cristalina del hierro. La reacción creada por el ánodo es la oxidación de los átomos de hierro (Fe) produciendo iones (Fe(+2)). Los electrones viajan en el hierro a través de las superficies mojadas de este. Al mismo tiempo, los iones (Fe(+2)) migran a los mismos lugares a través del agua en la superficie del hierro. En el cátodo, las moléculas disueltas de oxígeno (O2) se transforman, en presencia del agua (H2O), en iones de hidróxido (OH-). A continuación comienzan dos eventos químicos.
|
||
| • Arriba • |
Modificado el
Sábado, 27 Diciembre, 2003
|